 Kaju Yamaka
• 12 de jan, 2024
Kaju Yamaka
• 12 de jan, 2024
ENEM 2023
CIÊNCIAS DA NATUREZA E SUAS TECNOLOGIAS
QUESTÃO 129
Um assistente de laboratório precisou descartar sete frascos contendo solução de nitrato de mercúrio(I) que não foram utilizados em uma aula prática. Cada frasco continha 5,25 g de Hg₂(NO₃)₂ dissolvidos em água. Temendo a toxidez do mercúrio e sabendo que o Hg₂Cl₂ tem solubilidade muito baixa, o assistente optou por retirar o mercúrio da solução por precipitação com cloreto de sódio (NaCl), conforme a equação química:
Hg₂(NO₃)₂(aq) + 2NaCl(aq) => Hg₂Cl₂(s) + 2 NaNO₃(aq)
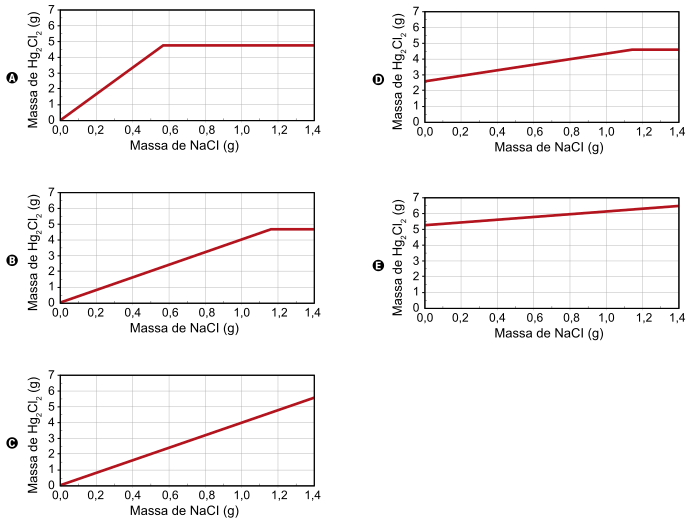
Na dúvida sobre a massa de NaCl a ser utilizada, o assistente aumentou gradativamente a quantidade adicionada em cada frasco, como apresentado no quadro.
| Frasco | I | II | III | IV | V | VI | VII |
|---|---|---|---|---|---|---|---|
| Massa de NaCl em grama (g) | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 |
O produto obtido em cada experimento foi filtrado, secado e teve sua massa aferida. O assistente organizou os resultados na forma de um gráfico que correlaciona a massa de NaCl adicionada com a massa de Hg₂Cl₂ obtida em cada frasco. A massa molar do Hg₂(NO₃)₂ é 525 g mol⁻¹, a do NaCl é 58 g mol⁻¹ e a do Hg₂Cl₂ é 472 g mol⁻¹.
Qual foi o gráfico obtido pelo assistente de laboratório?
Gabarito
(B)
Resolução
Sabemos que 1 mol de Hg₂(NO₃)₂ tem 525g. Então, 5,25g de Hg₂(NO₃)₂ correspondem a 0,01 mol (=5,25/525).
Com base na equação química do enunciado, sabemos que a quantidade de NaCl necessária para reagir com 0,01 mol de Hg₂(NO₃)₂ deverá ser de 0,02 mol.
Sabendo que a massa molar do NaCl é 58 g/mol, então 0,02 mol de NaCl correspondem a 1,16 g (= 0,02 × 58).
Ou seja, a partir de 1,16 g de NaCl não haverá mais precipitação de Hg₂Cl₂. O único gráfico constante a partir de 1,16 g de NaCl e uma reta a partir da origem é o (B).
Dúvidas e Comentários
Continua com dúvidas? Quer fazer um comentário?
Envie um email para: kaju.yamaka@gmx.com
Voltar para Homepage